A modalidade de cirurgia cardíaca mais realizada atualmente ainda é com a utilização da circulação extracorpórea (CEC). Por acaso você tem ideia de como é feito o desvio cardiopulmonar? Vamos ver resumidamente os passos neste artigo.
A maioria das cirurgias cardíacas é feita com o coração parado! A drenagem venosa, oxigenação sanguínea e bombeamento arterial é feito pela máquina de circulação extracorpórea, a famosa CEC.
Vou me permitir utilizar um neologismo oriundo da palavra inglesa para desvio, “bypass”. Durante a cirurgia cardíaca, o coração precisa ser “bypassado”, de forma que ele fique vazio e o sangue que deveria chegar pelas cavas seja redirecionado para a máquina de CEC, que oxigenará este sangue e devolverá ao organismo direto na aorta (em geral).
Alguns passos devem ser seguidos para que o coração seja adequadamente “bypassado”. Após o acesso ao mediastino anterior (comumente via esternotomia) e adequada hemostasia, é realizada abertura do pericárdio e reparo deste, para melhor exposição do coração.
Em seguida, são realizadas suturas em bolsa no sistema arterial e no sistema venoso cardíaco. As suturas em bolsa servirão para “garrotear” as cânulas venosa e arterial que serão inseridas com propósitos de drenagem e devolução sanguínea respectivamente. Os locais onde serão inseridas as cânulas dependem da cirurgia e outras especificidades. Numa cirurgia de revascularização miocárdica convencional, por exemplo, a cânula arterial vai na aorta e a cânula venosa vai no átrio direito.
Antes da canulação, o paciente deve ser heparinizado sistemicamente. O “quão anticoagulado” ele ficará será monitorizado pelo tempo de coagulação ativado (TCA). O mínimo que se exige é um TCA de 480 segundos, mas, comumente, a canulação é realizada com TCA maior que 600 segundos. Isso evita que coágulos se formem nos circuitos de CEC, um acontecimento que tem consequências catastróficas, para não dizer fatais.
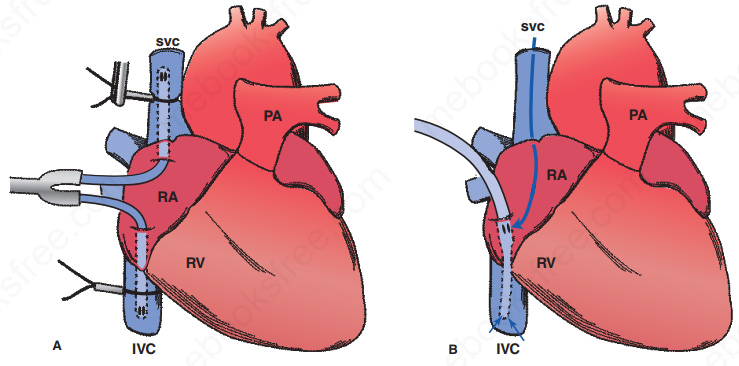
Figura 1 – Tipos de canulação venosa1
A figura acima mostra 2 tipos bastante comuns de canulação venosa. Na figura A temos a canulação bicaval, onde 2 cânulas venosas de estágio único são posicionadas na veia cava superior (VCS) e na veia cava inferior (VCI). As cânulas são conectadas à linha venosa por meio de um conector tipo Y. Na figura A, ambas as incisões foram feitas no átrio direito, mas, neste tipo de canulação, é comum a incisão direto nas veias cavas correspondentes. Na figura B temos a canulação atrial direita com uma cânula venosa duplo estágio. Neste tipo de canulação, o estágio distal faz a drenagem do sangue proveniente da VCI e o estágio proximal drena o sangue da VCS e do átrio direito.
Após a devida canulação, há o acoplamento a um conjunto de linhas (tubos de material inerte, comumente PVC) que conectarão o paciente à máquina de CEC. O sangue proveniente da linha venosa é desviado para a máquina apenas por ação da gravidade e é mantida durante toda a cirurgia pelo princípio de sifonagem. Em determinadas situações, um sistema de sucção à vácuo pode ser acoplado para melhorar a drenagem.
Para entender a lógica do desvio cardiopulmonar, relembremos brevemente a fisiologia da pequena e grande circulação (circulação pulmonar e sistêmica). O sangue venoso, rico em CO2 e pobre em O2, extraído dos tecidos corporais, chega ao coração direito (átrio e ventrículo direitos) através das veias cavas superior e inferior. Normalmente, ele segue trajeto rumo à microcirculação pulmonar, onde ocorrerá a hematose, retorna pelo coração esquerdo, onde será ejetado na aorta e distribuído de volta aos tecidos.
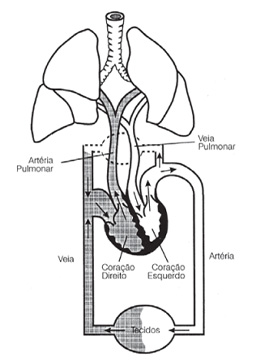
Figura 2 – Esquema demonstrando a pequena e grande circulação2
Durante a cirurgia cardíaca com CEC, trabalharemos com o coração parado, logo, este sangue deverá ser desviado para oxigenação extracorpórea. A máquina de CEC possui um oxigenador, que simula um pulmão artificial. O sangue proveniente da linha venosa sofrerá “arterialização”, processo que segue os princípios da difusão de Fick, ou seja, obedecem a um gradiente de concentração. Através de uma membrana semipermeável e um misturador de gases (blender), a pCO2 é reduzida e a pO2 aumentada (basicamente falando). O sangue arterializado seguirá através de outro conjunto de cânulas e linhas para o paciente, impelido por uma bomba propulsora.
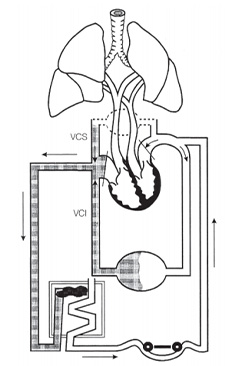
Figura 3 – Esquema mostrando o desvio do sangue venoso para a máquina, onde sofre arterialização e é impulsionado de volta para o sistema arterial nativo2
Após a canulação, é preciso, finalmente, desviar o coração, excluí-lo, fechar o circuito. O cirurgião autoriza o perfusionista a “entrar em CEC” assim que o paciente está adequadamente heparinizado. Assim se inicia a contagem do tempo de perfusão extracorpórea.
Logo após, distalmente ao local de inserção da cânula arterial, ocorre o clampeamento da aorta. Inicia-se aqui a contagem do tempo de isquemia. Isquemia por quê? Lembre-se que a perfusão coronariana se dá na diástole ventricular por refluxo do sangue da aorta. Com a aorta clampeada, não há refluxo de sangue em direção ao coração, logo, a perfusão coronariana vai a zero.
Para evitar qualquer injúria miocárdica pela isquemia, são injetadas, logo após o clampeamento da aorta, soluções cardioplégicas. A cardioplegia é uma solução de composição variável, mas rica em potássio, que induz parada cardíaca imediata em diástole, sem consumo de energia nem atividade elétrica detectável.
A máquina de circulação extracorpórea também possui um permutador térmico, que controla a temperatura do sangue que retornará ao paciente e pode induzir hipotermia ou realizar o reaquecimento após o procedimento. Juntos, hipotermia e cardioplegia fornecem a adequada proteção miocárdica durante a cirurgia.
Pronto, com a circulação desviada, o coração parado e adequadamente protegido, é iniciada a cirurgia. A solução de cardioplegia pode ser repetida de tempos em tempos (depende do tipo de solução), para manter o coração protegido enquanto durar o procedimento.
Próximo ao fim do tempo cirúrgico principal, o cirurgião autoriza o reaquecimento do paciente. Após o reaquecimento, ocorre o desclampeamento da aorta. O retorno da perfusão coronariana em um coração que foi bem protegido pela cardioplegia e hipotermia assumirá pouco a pouco o ritmo cardíaco e recupera a força de contração, reestabelecendo a fisiologia normal. O coração é, então, descanulado, a hemostasia é revisada, a anticoagulação revertida, drenos são passados, marcapassos epicárdicos são posicionados e a cavidade mediastinal está pronta para ser fechada.
É interessante a compreensão do funcionamento do desvio cardiopulmonar, pois as mesmas ideias alimentam os circuitos de oxigenação por membrana extracorpórea, ECMO, da sigla em inglês. A ECMO é uma alternativa à falência cardíaca ou pulmonar que é refratária ao tratamento clínico e teve significativa importância e visibilidade no tratamento dos nossos doentes durante a pandemia do novo coronavírus, Sars-Cov-2 (COVID-19).
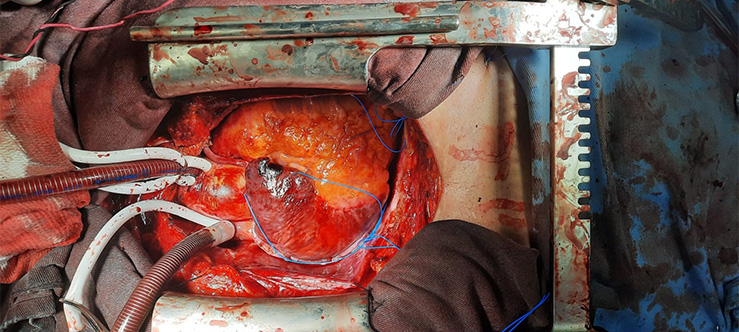
Figura 4 – Visão do cirurgião ao final de um procedimento cardíaco. Acervo próprio.
Na figura acima, vemos no plano mais inferior, o átrio direito com fios de marcapasso epicárdico já posicionados (em azul). À esquerda do átrio (superior, na posição anatômica), vemos a VCS canulada (em branco, o “garrote” da bolsa). Superiormente, temos a aorta, também canulada (note que o “garrote” das bolsas da aorta é duplo). A porção anterior do ventrículo direito também é visualizada, com seus fios de marcapasso epicárdico posicionados. É possível notar ainda uma ponte de safena na aorta (neste caso, foi revascularizada um dos ramos marginais da artéria circunflexa). Note que a aorta já se encontra desclampeada, pois a foto é de um dos momentos finais da cirurgia, anterior à descanulação.
Referências das figuras
[1] Hammon JW, Himes MH. Extracorporeal circulation. In: Cohn LH, Adams DH. Cardiac Surgery in the Adult. 5th Ed. McGraw Hill Education, 2018. Cap 13. p. 299-346.
[2] Souza MHL, Elias DO. Introdução à Circulação Extracorpórea. In: Souza MHL, Elias DO. Fundamentos de Circulação Extracorpórea. 2ª Ed. Rio de Janeiro, 2006. Cap 2. p.33-50.
Texto adaptado de:
Hammon JW, Himes MH. Extracorporeal circulation. In: Cohn LH, Adams DH. Cardiac Surgery in the Adult. 5th Ed. McGraw Hill Education, 2018. Cap 13. p.299-346.
Souza MHL, Elias DO. Introdução à Circulação Extracorpórea. In: Souza MHL, Elias DO. Fundamentos de Circulação Extracorpórea. 2ª Ed. Rio de Janeiro, 2006. Cap 2. p.33-50.
Harlan BJ. Preparation for Cardiopulmonary Bypass. In: Harlan BJ, Starr A, Harwin F. Manual of Cardiac Surgery. 2nd Ed. New York, 1995. Cap 4. p.23-32.
Kirklin/Barratt-Boyes. Hypothermia, Circulatory Arrest, and Cardiopulmonary Bypass. In: Kirklin/Barratt-Boyes. Cardiac Surgery.4th Ed. Philadelphia, 2013. Cap 2. p.67-132.
Chilton V, Klein A. Equipment and monitoring. In: Ghosh S, Falter F, Cook DJ. Cardiopulmonary Bypass. Cambridge Press, 2009.Cap1. p.1-22.
Chaves RC de F et al. Oxigenação por membrana extracorpórea: revisão da literatura. Rev. bras. ter. intensiva. 2019, vol.31, n.3, pp.410-424.